Kiel mallongaj telomeroj kaj inflamoj kontribuas al diabeto
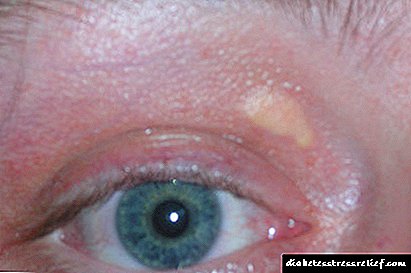
Mikrografo de homaj kromosomoj kun telomeroj (montritaj en rozo). (Foto: Mary Armanios)
Telomeroj ripetas sekvencojn de DNA, kiuj protektas la finojn de kromosomoj. Kiam la korpo maljuniĝas, ili kutime fariĝas pli mallongaj. En ĉi tiu kazo, la ĉeloj perdas sian kapablon dividi normale kaj finfine mortas. Mallongigo de telomeroj estas asociita kun kancero, pulmaj malsanoj kaj aliaj aĝoj rilataj al aĝo. Diabeto, ankaŭ asociita kun maljuniĝo, influas unu el kvar plenkreskuloj pli ol 60-jaraĝaj.
Studo farita de sciencistoj de la Universitato Johns Hopkins, publikigita en la revuo PLoS One, baziĝas sur observado de Mary Armanios, kiu nomis la atenton pri la ĉeesto de certa rilato inter la incidenco de diabeto kaj kongenita dyskeratosis (kuntekta kongresito), malofta hereda malsano kaŭzita de malobservo de la konservada mekanismo. telomeraj longoj. En pacientoj kun hereda dyskeratosis, ofte antaŭtempaj gravingoj kaj frua fiasko de multaj organoj ofte estas observataj.
“Kongenita diskeratosis estas malsano, kiu esence kaŭzas homojn antaŭtempe. Ni sciis, ke la efiko de diabeto pliiĝas kun la aĝo, tial ni sugestis, ke ankaŭ povus esti rilato inter telomeroj kaj diabeto ", komentis la studo Armanios, asociita profesoro pri onkologio en Kimmel Cancer Center, Universitato Johns Hopkins.
En pacientoj kun diabeto, ne sufiĉa insulino estas produktita, kaj iliaj ĉeloj ne povas uzi ĝin efike, kio kondukas al malobservo de la regulado de sanga sukero.
Armanios studis musojn per mallongaj telomeroj kaj iliaj insulinproduktantaj beta-ĉeloj. Ŝi trovis, ke malgraŭ la ĉeesto de granda sanaspekta beta-ĉeloj, la sanga sukero en ĉi tiuj musoj estis pli alta, kaj la ĉeloj sekrecis du malpli da insulino ol ĉe la bestoj de la grupo de kontrolo.
"Ĉi tio respondas al la fruaj stadioj de diabeto ĉe homoj, kiam la ĉeloj havas malfacilon sekrecii insulinon kiel respondon al sukero", Armanios klarigas. "En tiaj musoj ĉe multaj stadioj de sekrecio." insulino"De la produktado de energio per mitokondrioj ĝis signalado de kalcio, ĉeloj funkcias je duono de sia normala nivelo," diras Armanios.
En beta-ĉeloj de musoj kun mallongaj telomeroj, sciencistoj malkovris suprenreguligon de la geno p16 asociita kun maljuniĝo kaj diabeto. Krome, multaj genoj de la vojoj necesaj por sekrecio de insulino, inkluzive de la vojo, kiu regas signaladon de kalcio, estis ŝanĝitaj en ili. En la kontrolgrupo, ne tiaj eraroj estis detektitaj.
Iuj antaŭaj studoj montris, ke pacientoj kun diabeto povas havi mallongajn telomerojn, sed ĉu ĝi pliiĝas diabeto risko aŭ estas konsekvenco de ĉi tiu malsano, restis neklara.
“Maljuniĝo estas ĉefa riska faktoro por diabeto. Krome la familia heredeco ludas tre gravan rolon. La longeco de telomeroj estas hereda faktoro kaj povas igi homojn pli inklinaj al disvolvi diabeton, ”Armanios opinias.
Surbaze de ĉi tiu laboro, Armanios finas, ke telomera longo povas servi kiel biomarkilo de disvolviĝo diabeto. Por pliaj esploroj, scienculoj planas ekscii, ĉu eblas antaŭdiri la riskon disvolvi ĉi tiun malsanon surbaze de la telomera longo. "
Kiel mallongaj telomeroj kaj inflamoj kontribuas al diabeto
Kiel mallongaj telomeroj kaj inflamoj kontribuas al diabeto
Kial homoj kun multe da abdomena graso pliigas insulinan reziston kaj sian probablecon de diabeto? Netaŭga nutrado, malnomada vivstilo kaj streĉado kontribuas al la formado de abdomina graso kaj pliigo de sango-sukero. Ĉe homoj kun stomako, telomeroj malpliiĝas tra la jaroj <5>, kaj verŝajne ilia redukto pligravigas la problemon kun insulina rezisto. En dana studo, en kiu partoprenis 338 ĝemeloj, oni trovis, ke mallongaj telomeroj estas ŝirmantoj de pliigita insulina rezisto dum la sekvaj 12 jaroj. En ĉiu paro da ĝemeloj, unu el kies telomeroj estis pli mallongaj, montris pli grandan gradon de insulina rezisto <6>.
Sciencistoj plurfoje pruvis la asocion inter mallongaj telomeroj kaj diabeto. Mallongaj telomeroj pliigas la riskon disvolvi diabeton: homoj kun hereda mallonga telomera sindromo estas multe pli emaj sperti ĉi tiun malsanon ol la resto de la loĝantaro. Diabeto komenciĝas frue kaj progresas rapide. Studoj pri indianoj, kiuj pro diversaj kialoj riskas diabeton, donas ankaŭ seniluziigajn rezultojn. Ĉe indiano kun mallongaj telomeroj, la probableco de diabeto dum la sekvaj kvin jaroj estas duoble pli alta ol ĉe reprezentantoj de la sama etno kun longaj telomeroj <7>. Metaanalizo de studoj en sume pli ol 7.000 homoj montris, ke mallongaj telomeroj en sangaj ĉeloj estas fidinda signo de estonta diabeto <8>.
Ni ne nur konas la mekanismon de disvolviĝo de diabeto, sed ni eĉ povas rigardi en la pankreaton kaj vidi kio okazas en ĝi. Mary Armanios kaj kolegoj montris, ke ĉe musoj, kiam telomeroj reduktiĝas tra la tuta korpo (sciencistoj atingis tion per genetika mutacio), beta-ĉeloj de la pankreato perdas sian kapablon produkti insulinon <9>. Stemaj ĉeloj en la pankreato maljuniĝas, iliaj telomeroj fariĝas tro mallongaj, kaj ili ne plu kapablas replenigi la vicojn de beta-ĉeloj, kiuj respondecas pri insulina produktado kaj regulado de ties nivelo. Ĉi tiuj ĉeloj mortas. Kaj tipo 1a diabeto komerciĝas. Kun pli ofta tipo II-diabeto, beta-ĉeloj ne mortas, sed ilia agado malpliigas. Tiel ankaŭ en ĉi tiu kazo mallongaj telomeroj en la pankreato povas ludi rolon.
En alie sana persono, la ponto de abdomena graso al diabeto povas esti metita de nia malnova amiko - kronika inflamo. Abdomina graso kontribuas pli al la disvolviĝo de inflamo ol, ekzemple, graso en la koksoj. Adipaj histaj ĉeloj sekrecias kontraŭinflamatoriajn substancojn, kiuj damaĝas la ĉelojn de la imunsistemo, antaŭtempe igante ilin malpliiĝi kaj detrui siajn telomerojn. Kiel vi memoras, malnovaj ĉeloj, laŭvice, estas akceptitaj sendi senĉesajn signalojn, kiuj stimulas inflamon tra la korpo - vikia rondo estas akirita.
Se vi havas troan abdomenan grason, vi devas zorgi por protekti vin kontraŭ kronika inflamo, mallongaj telomeroj kaj metabola sindromo. Sed antaŭ ol daŭri dieton por forigi abdominan grason, legu ĉi tiun ĉapitron ĝis la fino: vi eble decidos, ke la dieto nur plimalbonigos. Ne zorgu: ni proponos al vi alternativajn manierojn normaligi vian metabolon.
Abstrakto de scienca artikolo pri medicino kaj sanzorgado, aŭtoro de scienca verko - Brailova Nataliya Vasilievna, Dudinskaya Ekaterina Nailevna, Tkacheva Olga Nikolaevna, Shestakova Marina Vladimirovna, Strazhesko Irina Dmitrievna, Akasheva Dariga Uaydinichna, Plokhova Ekaterina Vladimiro Vladkirovina Anatolyeviĉ
La celo de la studo estis studi la rilaton de kronika inflamo, oksida streso kaj telomera biologio en individuoj kun tipo 2 diabeto mellitus (T2DM). Materialo kaj metodoj. La studo inkluzivis 50 pacientojn kun tipo diabeto sen klinikaj manifestoj de kardiovaskula malsano (CVD) kaj 139 homoj en la grupo de kontrolo. Oni taksis la staton de karbonhidrata metabolo, la gradon de oksida streso (MDA-malondialdehido) kaj kronikan inflamon (fibrinogen, C-reaktiva CRP-proteino, interleŭkin-6 IL-6), mezuris la longecon de limfocitaj telomeroj kaj telomerasa aktiveco. Rezultoj En pacientoj kun tipo diabeto, la telomera longo estis pli mallonga (p = 0.031), la telomerasa aktiveco estis pli malalta (p = 0.039), kaj la grado de inflamo (CRP kaj fibrinogeno-niveloj) estis pli alta ol en la grupo de kontrolo. Ĉiuj pacientoj estis dividitaj laŭ telomera longo. Inter pacientoj kun T2DM, CRP kaj fibrinogeno niveloj estis pli altaj en individuoj kun mallongaj telomeroj (p = 0.02). Komparante grupojn kun "longaj" telomeroj, neniuj diferencoj estis trovitaj en la nivelo de CRP (p = 0.93). En pacientoj kun tipo diabeto kaj "malalta" telomerasa aktiveco, la severeco de kronika inflamo estis plej granda. En pacientoj kun tipo 2 diabeto, rilato estis trovita inter la telomera longo kaj la nivelo de CRP (r = -0.40, p = 0.004). Konkludo Kronika inflamo kaj ĉela maljuniĝo en pacientoj kun tipo 2 diabeto estas pli prononcitaj ol en la kontrolo. Tamen en pacientoj kun "longaj" telomeroj, la signoj de kronika inflamo ne multe diferencis de tiuj en sanaj homoj. Eble "longaj" telomeroj protektas pacientojn kun T2DM de la damaĝaj efikoj de kronika inflamo.
Telomera longo, telomerasa aktiveco kaj mekanismoj ŝanĝiĝas en pacientoj kun tipo 2 diabeto mellitus
Celu. Studi la asocion de kronika inflamo, oksida streso kun telomeraj biologio en homoj kun tipo 2 diabeto mellitus (T2DM). Materialo kaj Metodoj. Entute 50 pacientoj kun T2D kaj sen kardiovaskula malsano (CVD) kaj 139 homoj de kontrolgrupo estis inkluditaj en la studo. Ĉiuj subjektoj estis mezuritaj pro karbonhidrata metabolo, oksida streso (malondialdehido (MDA)), inflamo (C-reaga proteino CRP, fibrinogeno, interleŭkinino-6), limfocito-telomera longo, telomerasa aktiveco. Rezultoj En diabetaj pacientoj, telomeroj estis pli mallongaj ol ĉe kontroloj (9,59 ± 0,54 kaj 9,76 ± 0,47, p = 0,031), telomerasa aktiveco estis pli malalta (0,47 ± 0,40 kaj 0,62 ± 0,36, p = 0,039), inflamo (CRP, pliigita fibrinogeno) estis pli alta . Ĉiuj pacientoj estis div> telomere longaj. En T2DM-grupo CRP estis pli alta en pacientoj kun "mallongaj" telomeroj (7,39 ± 1,47 kaj 3,59 ± 0,58 mg / L, p = 0,02). Ne estis signifaj diferencoj en la nivelo de kronika inflamo kaj oxidativa streso en la 'longaj' telomerioj: CRP 3,59 ± 0,58 kaj 3,66 ± 0,50 mg / L (p = 0,93), MDA 2,81 ± 0,78 kaj 3,24 ± 0,78 mmol / l ( p = 0,08). Diabetikaj pacientoj en "mallongaj" telomerioj havis pli grandan kronikan inflamon: CRP 7.39 ± 1.47 kaj 4.03 ± 0.62 mg / L (p = 0.046), pliigita fibrinogeno, 0.371 kaj 0.159 (p = 0.022). Ĉiuj pacientoj estis div> telomerasa aktiveco. Graveco de kronika inflamo estis plej granda en T2DM kaj la "malalta" aktiveco de telomerazo. Estis rilatoj inter telomere-longo kaj CRP en T2DM-pacientoj (r = -0.40, p = 0.004). Konkludoj. Kronika inflamo kaj ĉela maljuniĝo estis pli prononcitaj en pacientoj kun T2DM. Tamen, malgraŭ diabeto, signoj de kronika inflamo estis minimumaj en pacientoj kun "longaj" telomeroj kompare al sanaj homoj. Eble longaj telomeroj protektas diabetajn pacientojn kontraŭ la damaĝa efiko de kronika inflamo.
La teksto de la scienca laboro pri la temo "Telomera longo, telomerasa aktiveco, kaj mekanismoj de ilia ŝanĝo en paciento kun tipo 2 diabeto"
Telomera longo, telomerasa agado kaj mekanismoj de ilia ŝanĝo en paciento kun tipo 2 diabeto
Ph.D. N.V. BRAYLOVA1 *, Ph.D. E.N. DUDINSKAYA1, MD O.N. TKACHEVA1, responda membro RAS M.V. SHESTAKOVA2, Ph.D. I.D. STRASHESKO1, kandidato de medicinaj sciencoj D.U. AKASHEV1, E.V. PLOKHOVA1, V.S. Pykhtina1, V.A. VYGODIN1, prof. S.A. Batalantoj1
1 FSBI "Ŝtata Centro pri Esplora Medicino", Moskvo, Rusio, 2 FSBI "Endocrinologia Esplora Centro" de la Ministerio pri Sano de Rusio, Moskvo, Rusio.
La celo de la studo estis studi la rilaton de kronika inflamo, oksida streso kaj telomera biologio en individuoj kun tipo 2 diabeto mellitus (T2DM).
Materialo kaj metodoj. La studo inkluzivis 50 pacientojn kun tipo diabeto sen klinikaj manifestoj de kardiovaskula malsano (CVD) kaj 139 homoj en la grupo de kontrolo. La stato de karbonhidrata metabolo, la grado de oksida streso (malondialdehido - MDA) kaj kronika inflamo (fibrinogeno, C-reaga proteino - CRP, interleukino-6 - IL-6) estis taksita, la longo de limfocitaj telomeroj kaj telomerasa aktiveco estis mezurita.
Rezultoj En pacientoj kun tipo diabeto, la telomera longo estis pli mallonga (p = 0.031), la telomerasa aktiveco estis pli malalta (p = 0.039), kaj la grado de inflamo (CRP kaj fibrinogeno-niveloj) estis pli alta ol en la grupo de kontrolo. Ĉiuj pacientoj estis dividitaj laŭ telomera longo. Inter pacientoj kun T2DM, CRP kaj fibrinogeno niveloj estis pli altaj en individuoj kun mallongaj telomeroj (p = 0.02). Komparante grupojn kun "longaj" telomeroj, neniuj diferencoj estis trovitaj en la nivelo de CRP (p = 0.93). En pacientoj kun tipo diabeto kaj "malalta" telomerasa aktiveco, la severeco de kronika inflamo estis plej granda. En pacientoj kun tipo 2 diabeto, rilato estis trovita inter la telomera longo kaj la nivelo de CRP (r = -0.40, p = 0.004).
Konkludo Kronika inflamo kaj ĉela maljuniĝo en pacientoj kun tipo 2 diabeto estas pli prononcitaj ol en la kontrolo. Tamen en pacientoj kun "longaj" telomeroj, la signoj de kronika inflamo ne multe diferencis de tiuj en sanaj homoj. Eble "longaj" telomeroj protektas pacientojn kun T2DM de la damaĝaj efikoj de kronika inflamo.
Ŝlosilvortoj: Telomera longo, telomerasa agado, diabeto mellitus, kronika inflamo, oksidiga streso.
Telomera longo, telomerasa aktiveco kaj mekanismoj ŝanĝiĝas en pacientoj kun tipo 2 diabeto mellitus
N.V. BRAILOVA1, E.N. DUDINSKAYA1, O.N. TKACHEVA1, M.V. SHESTAKOVA2, I.D. STRAZHESKO1, D.U. AKASHEVA1, E.V. PLOCHOVA1, V.S. PYKHTINA1, V.A. VYGODIN1, S.A. BOYTSOV1
'Nacia Esplorcentro por Antaŭzorga Medicino, Moskvo, Rusio, 2 Esplorcentro pri Endokrinologio, Moskvo, Rusio
Celu. Studi la asocion de kronika inflamo, oksida streso kun telomeraj biologio en homoj kun tipo 2 diabeto mellitus (T2DM).
Materialo kaj Metodoj. Entute 50 pacientoj kun T2D kaj sen kardiovaskula malsano (CVD) kaj 139 homoj de kontrolgrupo estis inkluditaj en la studo. Ĉiuj subjektoj estis mezuritaj por karbonhidrata metabolo, oxelomeres-grupo: CRP 3,59 ± 0,58 kaj 3,66 ± 0,50 mg / L (p = 0,93), MDA 2,81 ± 0,78 kaj 3,24 ± 0,78 mmol / l (p = 0,08). Diabetikaj pacientoj en "mallongaj" telomerioj havis pli grandan kronikan inflamon: CRP 7.39 ± 1.47 kaj 4.03 ± 0.62 mg / L (p = 0.046), pliigita fibrinogeno, 0.371 kaj 0.159 (p = 0.022). Ĉiuj pacientoj estis div>
Konkludoj. Kronika inflamo kaj ĉela maljuniĝo estis pli prononcitaj en pacientoj kun T2DM. Tamen, malgraŭ diabeto, signoj de kronika inflamo estis minimumaj en pacientoj kun "longaj" telomeroj kompare al sanaj homoj. Eble longaj telomeroj protektas diabetajn pacientojn kontraŭ la damaĝa efiko de kronika inflamo.
Ŝlosilvortoj: Telomera longo, telomerasa aktiveco, diabeto mellitus, kronika inflamo, oksidiga streĉiteco.
Oxidativa streso kaj kronika inflamo kiel bazo por biologia maljuniĝo
Diabeto mellitus (DM) estas akompanata de akcelitaj ŝanĝoj en sangaj glasoj, kio faras ĝin ĉefa kaŭzo de kardiovaskula malsano (CVD) kaj morteco. Ŝlosila datuma ligo
ŝanĝoj - hiperglicemio, insulina rezisto, amasiĝo de finaj produktoj de glicemio (CNG). Hiperinsulinemia kaj hiperglicemio, same kiel fiziologia maljuniĝo, aktivigas la procezojn de kronika inflamo kaj oksidiga streso. En maljuniĝanta korpo, kiel en an
malalta nivelo de paciento kun diabeto, la nivelo de diversaj markiloj de inflamo pliigas C-reaktan proteinon (CRP), IL-18, TNF-a ("inflamado"), pliigas la agadon de lipida peroksidado kun la formado de malondialdehido (MDA) kaj reaktiva oksigena speco (ROS) . Ĉio ĉi kondukas al difektita proteina sintezo, ĉela apoptozo kaj disvolviĝo de degeneraj procezoj.
Biologio de telomeroj en individuoj kun tipo 2 diabeto
Unu el la kialoj de la malsama rapideco de vaskula maljuniĝo en pacientoj kun tipo 2 diabeto estas la komence malsama "genetika protekto" kontraŭ ekspozicio al eksteraj faktoroj. La telomera longo kaj telomerasa agado povas postuli la rolon de genetikaj markiloj de la biologia aĝo de sangaj glasoj. Telomeroj estas la ekstremaj sekcioj de lineara DNA-molekulo, kiuj iom post iom estas mallongigitaj kun ĉiu ĉela divido. Tuj kiam la longeco de la telomera ADN fariĝas danĝere malalta, P53 / P21, induktita maljuniĝo de la ĉelo, konserviĝas konservante sian metabolan agadon. Estas evidenteco, ke la longeco de telomeroj en leŭkocitoj reflektas la longon de telomeroj en sternaj ĉeloj kaj korespondas kun ilia longeco en endoteliaj progenitaj ĉeloj, kio permesas nin konsideri ĉi tiun parametron kiel biomarkilon de vaskula maljuniĝo. La unuaj indikoj pri mallongigo de telomeroj en individuoj kun tipo 2-diabeto kaj malpliiĝinta glukoza toleremo estis akiritaj. Mallongigo de telomeroj povas esti asociita kun la disvolviĝo de T2DM, CVD kaj vaskula maljuniĝo.
Dua genetika markilo de biologia aĝo eble estas telomerasa aktiveco. Telomerase estas enzimo kiu aldonas specialajn ripetiĝantajn DNA-sekvencojn al la 3'-fino de la DNA-ĉeno kaj inkluzivas telomerazan inversan transkriptasezon (TERT) kaj telomerazan RNA (TERC). En plej somataj ĉeloj, telomerasa aktiveco estas sufiĉe malalta. Kvankam telomerase ne ludas gravan rolon en telomejaj longhejtostoj en maljuneco, oni kredas, ke ĉi tiu enzimo havas gravajn ne-telomerajn funkciojn por redukti apoptozon, regi ĉelan proliferadon kaj mitokondrian agadon en homaj ĉeloj.
La rolo de kronika inflamo kaj oxidado
streĉiteco en ŝanĝoj en telomera longo kaj agado
telomerase en individuoj kun tipo 2 diabeto
La ĉefaj ellasiloj de la patologiaj procezoj asociitaj kun maljuniĝo ĉe la ĉela nivelo estas konsiderataj oksidativa streso kaj kronika inflamo, kaŭzante ne-replikatan mallongigon de DNA. Telomere Sentema
Ili respondecas pri oksidiga damaĝo al la DNA-molekulo. In vitro ROS reduktas la enhavon de hTERT nuklea proteino en endoteliaj ĉeloj kaj, sekve, telomerasa aktiveco. Telomerase povas protekti blankajn globulojn de oxidativa streso sen tuŝi la longon de telomeroj. Pliigita inflama agado akcelas telomere mallongigon ambaŭ pro aktivigo de ĉela reproduktado kaj pro liberigo de ROS. La progresiva mallongigo de telomeroj kun pliigo de la daŭro de T2DM povas esti asociita al kronika inflamo kaj oksidiga streso. La rilato inter telomerasa agado kaj kronika inflamo estas miksita. Kronika inflamo frue per diversaj signalaj vojoj (kun NF-kB, proteino kinase C aŭ Akt kinase) per fosforilado aŭ transskribo de hTERT povas aktivigi telomerazon, kiu,
Informoj pri la aŭtoroj:
Brailova Natalia Vasilievna - Ph.D. Dep.studo pri maljuniĝo kaj preventado de aĝoj rilataj al malsanoj de la Ŝtata Esplora Centro por Antaŭzorga Medicino, Moskvo, Rusio, retpoŝte: [email protected],
Dudinskaya Ekaterina Nailevna - Kandidato de Medicinaj Sciencoj, Altranga Esploristo Dep. studo pri maljuniĝo kaj preventado de malsanaj aĝoj de la Federacia Ŝtata Buĝeta Institucio "Ŝtata Centro pri Esplora Medicino", Moskvo, Rusio
Tkacheva Olga Nikolaevna - MD, prof., Manoj. Dep. studado de maljuniĝaj procezoj kaj antaŭzorgo de aĝaj rilataj malsanoj FSBI Ŝtata Centro pri Antaŭzorga Medicino, Moskvo, Rusio, Ŝstakova Marina Vladimirovna - responda membro. RAS, Direktoro de la Instituto pri Diabeto, Deputito cervoj Scienca laboro de la Federacia Ŝtata Buĝeta Institucio "Endocrinologia Scienca Centro", Moskvo, Rusio, Strazhesko Irina Dmitrievna - kandidato de medicinaj sciencoj, supera esploristo Dep. studo pri maljuniĝo kaj preventado de malsanaj aĝoj de la Federacia Ŝtata Buĝeta Institucio "Ŝtata Centro pri Esplora Medicino", Moskvo, Rusio,
Akasheva Dariga Uaydinichna - kandidato de medicinaj sciencoj, supera esploristo Dep. studo pri maljuniĝo kaj preventado de malsanaj aĝoj de la Federacia Ŝtata Buĝeta Institucio "Ŝtata Centro pri Esplora Medicino", Moskvo, Rusio,
Plokhova Ekaterina Vladimirovna - kandidato de medicinaj sciencoj, supera esploristo Dep. studo pri maljuniĝo kaj preventado de malsanaj aĝoj de la Federacia Ŝtata Buĝeta Institucio "Ŝtata Centro pri Esplora Medicino", Moskvo, Rusio,
Pykhtina Valentina Sergeevna - laboratorio. Dep. studo pri maljuniĝo kaj preventado de malsanaj aĝoj de la Federacia Ŝtata Buĝeta Institucio "Ŝtata Centro pri Esplora Medicino", Moskvo, Rusio,
Vygodin Vladimir Anatolyevich - supera esploristo laboratorio. biostatistika Federacia Ŝtata Buĝeta Institucio "Ŝtata Centro de Esploro por Antaŭzorga Medicino", Moskvo, Rusio, Sergey Anatolyevich Boytsov - MD, profesoro, manoj. Dep. Kardiologio kaj Molekula Genetiko, Direktoro, Ŝtata Esplorcentro por Antaŭzorga Medicino, Moskvo, Rusio
Piano, kompensas por la akcelita mallongigo de la korpaj mezuroj. Tamen en la malfruaj stadioj de malrapida inflamo, telomerasa aktiveco malpliiĝas, kio kondukas al mallongigo de telomeroj.
La celo de la studo estis studi la rilaton de kronika inflamo kaj oksida streso kun telomeraj biologio en individuoj kun tipo 2 diabeto.
Materialo kaj metodoj
Unu-etaĝa studo inkluzivis pacientojn kun tipo 2-diabeto, kiuj submetiĝis al ekstertera ekzameno ĉe la Federacia Ŝtata Buĝeta Scienca Esplora Centro por Kirurgio en 2012-2013. La ĉefa grupo konsistis el pacientoj en aĝo de 45 ĝis 75 jaroj kun daŭro de malsano ne pli ol 12 monatoj kaj enhavo de HbA1c de 6,5 ĝis 9,0%. La grupo de kontrolo inkluzivis homojn sen T2DM, kiuj ne havis klinikajn manifestojn de CVD, kiuj turniĝis al la centro por preventa konsilado.
Ekskluzivaj kriterioj: tipo 1-diabeto kaj aliaj specifaj specoj de diabeto, arteria hipertensio (hipertensio) de grado 3 (sangopremo> 180/100 mm Hg), regula uzo de kontraŭhipertensaj drogoj, regula uzo de kontraŭhipertensaj drogoj, severaj diabetaj mikrogigiopatioj (antaŭproliferativa kaj prolifera diabeta retinopatio, kronika rena malsano de la etapoj 3b, 4 kaj 5), CVD (kronika korinsuficienco, gradoj II - IV (NYHA), valvula kormalsano), kronika hepata malsano, kancero, gravedeco, laktado.
Ĉiuj pacientoj subskribis informitan konsenton por partopreni en la studo. La studa protokolo estis aprobita de la loka komitato pri etiko de la FSBI GNITsPM de la Ministerio pri Sano de Rusio. Protokolo de la kunveno de LEK n-ro 8 de la 11.29.11.
En la kribra stadio, ĉiuj pacientoj spertis norman klinikan ekzamenon: preno de historio, klinika ekzameno, inkluzive de mezurado de korpa pezo kaj alteco kun kalkulado de korpa masa indekso (IMC), mezurado de sistola (SBP) kaj diastola sangopremo (DBP) sur kalibrita aparato. uzante ŝultran manplaton (HEM-7200 M3, Omron Healthcare, Japanio). La sangopremo estis mezurita post 10-minuta ripozo sur la dekstra brako en sidanta pozicio 3 fojojn post 2 minutoj, la mezumo de tri mezuradoj estis inkluzivita en la analizo. Sango estis prenita por laboratoriotestoj (klinika kaj biokemia), ECG estis registrita, kaj fizika ekzercotestado estis farita sur la treadmill-testo uzante la BRUCE-protokolon (Intertrack, SCHILLER). El la 250 pacientoj ekzamenitaj, 189 renkontis la inkluzivajn kriteriojn. La stato de la karbonhidrata metabolo estis taksita en ĉiuj ili, la telomera longo kaj la telomerasa agado estis determinitaj, kaj la severeco de la oksida streso kaj kronika inflamo estis registritaj.
Karbonhidrata metabolo
Plasma glukoza koncentriĝo estis determinita per la glukoza oksidasa metodo en analizilo SAPPHIRE-400 per DiaSys-diagnozoj. La nivelo de HbA1c estis registrita per likva kromatografio en Sapphire 400-analizilo (Niigata-Mecatronika, Japanio) laŭ la procedo de norma fabrikanto.
Mezuro de Telomere-Longeco
La mezurado de la relativa longo de la telomeroj de ekstercentraj limfocitoj estis farita sur genoma DNA. Dum realtempa PCR-analizo, la kvanto de DNA kun telomera sinsekvo en la genomo estis taksita. Paralele, realtempa PCR estis farita sur sola kopio de la genoma DNA. Ni eliris el la proporcia proporcio de la nombroj de telomeraj kaj unuopaj matricoj al la longo de la telomeroj.
Mezuro de telomerasa agado
Por determini telomeragan agadon, tekniko kun iuj modifoj estis uzata. La enzima agado estis esplorita en la elektita monocita frakcio de sangaj ĉeloj (proksimume 10.000 ĉeloj per analizo). Monokaj ĉeloj estis lisitaj kun milda detergenta bufro, apartiganta la eltiraĵon. Reago de telomerasa polimerazo efektivigis per la ekstrakto; la akiritaj produktoj estis amplifitaj per PCR en reala tempo. La kvanto de telomerase-reakciaj produktoj estas proporcia al telomerasa aktiveco (amplifilo de Mastercycler (Eppendorf, Germanio)).
Oxidativa Stresa Takso
Por taksi la severecon de la oksida streso, la koncentriĝo de MDA estis studita per la metodo de lumol-dependa kemiluminescenco en tuta sango.
Takso de kronika inflamo
Por taksi la severecon de kronika inflamo, ni studis la koncentriĝon de fibrinogeno, tre sentema C-reaktiva proteino (CRP) (imunoturbodimetria metodo per SAPPHIRE-400-analizilo), IL-6 (imuno-enzima metodo).
Plenumo de biomedika etiko
La studo estis farita konforme al normoj pri Bona Klinika Praktiko kaj la principoj de la Helsinka Deklaro. La studa protokolo estis aprobita de la Etikaj Komitatoj de ĉiuj partoprenantaj klinikaj centroj. Antaŭ inkludo en la esplorado
Ĉiuj partoprenantoj ricevis skriban informitan konsenton.
Ni uzis la pakaĵon de aplikataj statistikaj programoj SAS 9.1 (Statistika Analiza Sistemo, SAS Instituto Inc., Usono). Ĉiuj datumoj estis enmetitaj en tabulan procesoron, poste oni faris esploran analizon por identigi enirajn erarojn kaj mankantajn valorojn. Por kvantaj parametroj, la malsimetria testo kaj kurtosis estis uzataj, kio malkaŝis la normalan distribuon de plej multaj parametroj. Kvantaj datumoj estas prezentitaj kiel mezaj valoroj kaj normaj devioj (M ± SD). La mezaj valoroj de klinikaj parametroj estis komparitaj en du grupoj per samtempa analizo por kontinuaj variabloj kaj x2-kriterio por kategoriaj variabloj. Por frekvencaj indikiloj, modifita kriterio de Student 'estis uzata konsiderante la transformon de Fcsher arcsin. Por identigi mezuron de la lineara rilato inter la parametroj, korelacia analizo (Spearman-rango-korelacioj) estis farita. Por taksi la sendependajn rilatojn inter la parametroj, multidimensiaj regresaj ekvacioj kaj multoblaj linearaj regresaj analizoj estis uzataj. Post mezurado de la telomera longo, plia divido de pacientoj en rangojn efektiviĝis depende de la parametraj valoroj. La unua rango-grupo inkluzivis pacientojn kun tre mallonga longo de telomero: de la minimuma valoro en la ĝenerala grupo ĝis la limo de la unua kvartilo (t.e., sub 25% de la distribua limo). La dua rango grupo inkluzivis pacientojn kun telomeraj longoj de meza distribuo ĝis pli malaltaj kvartaloj. La grupo de tria rango inkluzivis pacientojn kun telomeraj longoj de la meza distribuo ĝis 75% de la limo de distribuo. Personoj kun tre granda telomera longo, kiu konsistigas la supran kvartelon de la distribuo, estis asignitaj al la kvara rangogrupo. La nula hipotezo estis malakceptita ĉe p i Ne povas trovi kion vi bezonas? Provu la literatur-elektan servon.
Entute 189 pacientoj (64 viroj kaj 125 virinoj) estis inkluzivitaj en la studo, kiuj estis kombinitaj en du grupoj: kun T2DM (i = 50) kaj sen diabeto (i = 139). La daŭro de T2DM estis 0,9 + 0,089 jaroj. La averaĝa aĝo de pacientoj kun tipo diabeto estis 58,4 ± 7,9 jaroj, kaj la kontrolgrupo - 57,45 + 8,14 jaroj (p = 0,48). En la grupo SD2, la SBP estis 131,76 + 14,7 mm Hg, kaj en la kontrolgrupo - 127,78 + 16,5 mm Hg. (p = 0.13). La MDA-nivelo en la grupo T2DM estis 3.193 + 0.98 μmol / L, kaj en la grupo de kontrolo ĝi estis 3.195 + 0.82 μmol / L (p = 0.98). La meza nivelo de IL-6 en la grupo T2DM estis 3,37 + 1,14 pg / ml, en la grupo de kontrolo ĝi estis 5,07 + 0,87 pg / ml (p = 0,27).
En la diabeta grupo, la proporcio de viroj estis pli alta ol en la grupo de sanaj individuoj (46% kontraŭ 29%) (p = 0,013). La vira / virina proporcio en la grupo T2DM estis 46/54% kontraŭ 29/71% en la grupo de kontrolo (^ = 0,013). La IMC de pacientoj kun tipo diabeto estis signife pli alta ol ĉe sanaj individuoj: 30,28 ± 5,42 kontraŭ 27,68 ± 4,60 kg / m2 (p = 0,002). DBP en la T2DM-grupo estis 83,02 ± 11,3 mm Hg. kontraŭ 78,6 ± 9,3 mmHg en la kontrolgrupo (p = 0,015). En pacientoj kun diabeto tipo 2, la longeco de limfocitaj telomeroj estis signife pli mallonga (p = 0.031), kaj telomerasa agado estis signife pli malalta (p = 0.039) ol ĉe sanaj individuoj. En la T2DM-grupo, la rapidaj plasmaj glukozoj (GPN) kaj HbA1c-niveloj estis signife pli altaj ol en la kontrolgrupo (p Mi ne povas trovi kion vi bezonas? Provu la literatur-selektan servon.
mer 9,59 + 0,54 9,76 + 0,47 0,031
Telomerasa agado 0,47 + 0,40 0,62 + 0,36 0,039
MDA, μmol / L 3,19 + 0,98 3,20 + 0,82 0,98
IL-6, pg / ml 3,37 + 1,14 5,07 + 0,87 0,27
CRP, mg / L 6,34 + 1,06 3,82 + 0,41 0,031
Fibrinogeno, g / l 3,57 + 0,87 3,41 + 0,54 0,23
fibrinogeno 0,30 + 0,04 0,11 + 0,03 0,004
Tabelo 2. Indikiloj de karbonhidrata metabolo, oksida streso, kronika inflamo, telomera longo kaj telomerasa agado, depende de la ĉeesto de T2DM
SD2 + ("= 50) ___ SD2- (" = 139)
Parametraj longaj korp-mezuroj ("= 15) mallongaj korp-mezuroj (" = 35) P longaj korp-mezuroj ("= 76) mallongaj korp-mezuroj (" = 63) P
HbA1c,% 11,54 + 3,57 13,48 + 3,24 0,072 10,98 + 1,83 11,59 + 2,03 0,075
GPN, mmol / L 0.83 + 0.13 0.95 + 0.17 0.02 0.76 + 0.16 0.78 + 0.14 0.59
MDA, μmol / L 2,81 + 0,78 3,35 + 1,04 0,09 3,24 + 0,78 3,14 + 0,87 0,58
CRP, mg / L 3,59 + 0,58 7,39 + 1,47 0,02 3,66 + 0,50 4,07 + 0,68 0,63
Fibrinogeno, g / l 3,39 + 0,55 3,70 + 0,59 0,15 3,38 + 0,53 3,44 + 0,55 0,5
Ĉeesto de pliigita fibrinogeno 0,143 0,371 0,09 0,069 0,159 0,09
IL-6, pg / ml 5,95 + 3,89 2,43 + 0,51 0,39 5,70 + 1,31 4,41 + 1,08 0,45
Telomerasa aktiveco 0,51 + 0,09 0,47 + 0,08 0,78 0,60 + 0,05 0,66 + 0,07 0,42
"Malalta" telomerasa aktiveco 0.417 0.710 0.09 0.512 0.474 0.73
Tabelo 3. Indikiloj de oxidativa streso, kronika inflamo kaj telomerasa agado depende de la relativa longo de la telomeroj
Longaj telomeroj Mallongaj telomeroj
Parametro SD2 + ("= 15) SD2- (" = 76) P SD2 + ("= 35) SD2- (" = 63) P
MDA, μmol / L 2,81 + 0,78 3,24 + 0,78 0,08 3,35 + 1,04 3,14 + 0,87 0,35
CRP, mg / L 3,59 + 0,58 3,66 + 0,50 0,93 7,39 + 1,47 4,03 + 0,62 0,046
Fibrinogeno, g / l 3,39 + 0,55 3,38 + 0,53 0,95 3,70 + 0,51 3,44 + 0,55 0,513
Ĉeesto de pliigita fibrinogeno 0,143 0,069 0,40 0,371 0,159 0,022
IL-6, pg / ml 5,94 + 3,89 5,70 + 1,31 0,94 2,43 + 0,51 4,41 + 1,08 0,10
Telomerasa aktiveco 0,51 + 0,09 0,60 + 0,05 0,36 0,47 + 0,08 0,62 + 0,07 0,063
"Malalta" telomerasa aktiveco 0.512 0.417 0,56 0,57 0,474 0,049
Tabelo 4. Indikiloj de karbonhidrata metabolo, oksida streso, kronika inflamo, telomera longo kaj telomerasa aktiveco (AT), depende de la ĉeesto de T2DM
Parametro SD2 + SD2- R
alta AT malalta AL P alta alta AT malalta AT
HbA1c,% 7,19 + 0,60 7,36 + 0,80 0,45 5,19 + 0,58 5,35 + 0,41 0,16
GPN, mmol / L 7,55 + 1,40 8,47 + 1,79 0,09 5,17 + 0,51 5,33 + 0,44 0,14
MDA, μmol / L 2,93 + 0,90 3,23 + 1,01 0,34 3,06 + 0,93 3,34 + 0,72 0,25
IL-6, pg / ml 2,98 + 1,01 1,91 + 2,03 0,68 3,77 + 1,00 6,37 + 1,80 0,21
CRP, mg / L 5,34 + 1,40 7,12 + 1,76 0,43 4,14 + 0,78 2,55 + 0,26 0,06
Fibrinogeno, g / l 3,62 + 0,70 3,66 + 0,85 0,87 3,60 + 0,50 3,37 + 0,43 0,034
Ĉeesto de pliigita fibrinogeno 0,375 0,259 0,43 0,205 0,075 0,09
Relativa telomera longo 9,77 + 0,50 9,43 + 0,42 0,02 9,81 + 0,51 9,70 + 0,45 0,33
sanaj pacientoj inter personoj kun "mallongaj" kaj "longaj" telomeroj, ne estis signifaj diferencoj koncerne karbohidratan metabolon, severecon de oxidativa streso kaj kronika inflamo (Tabelo 2).
En pacientoj kun T2DM kaj "mallongaj" telomeroj, la nivelo de CRP estis signife pli alta kaj pliigita fibrinogeno estis pli ofta. Diferencoj en la niveloj de MDA, fibrinogeno, IL-6 ne estis detektitaj. Telomerasa aktiveco estis iomete pli malalta ĉe pacientoj kun tipo 2 diabeto kaj mallongaj telomeroj (9 = 0.063). "Malaltaj" indikiloj de telomerasa aktiveco estis trovitaj en pacientoj kun T2DM kaj "mallongaj" korpaj mezuroj signife pli ofte (9 = 0.049).
En individuoj kun longaj telomeroj, markiloj de kronika inflamo kaj oksida streso, same kiel telomerasa aktiveco, estis preskaŭ sendependaj de la ĉeesto de T2DM (Tabelo 3).
La meza telomerasa agado estis 0.50. Ĉiuj pacientoj kun malpli alta valoro de ĉi tiu indikilo estis asignitaj al la grupo de "malalta" telomerasa aktiveco, kaj tiuj, kies telomerasa aktiveco superis ĉi tiun valoron, al la grupo de "alta" telomerasa aktiveco. En pacientoj kun diabeto tipo 2, la stato de karbonhidrata metabolo, la agado de markiloj de oksida streso kaj kronika inflamo ne diferencis inter ĉi tiuj grupoj, escepte de pli mallongaj telomeroj en la grupo kun "malalta"
telomerase (p = 0,02). La grupo de kontrolo ankaŭ ne malkaŝis dependecon de la niveloj de oksida streso, CRP kaj IL-6 de telomerasa aktiveco, tamen, homoj kun "alta" telomerasa aktiveco montris pli altajn nivelojn de fibrinogeno (Tabelo 4).
En pacientoj kun T2DM kaj "malalta" telomerasa aktiveco, CRP estis pli alta, pliigita fibrinogeno estis pli ofta, kaj la longo de la telomero estis pli mallonga. La niveloj de IL-6, MDA kaj fibrinogeno en la grupo de "malalta" telomerasa aktiveco ne dependis de la ĉeesto de T2DM. En la grupo de "alta" telomerasa agado, vizaĝoj kun T2DM + kaj T2DM ne diferencis rilate al oksida streso, kronika inflamo kaj telomera longo (Tabelo 5).
En pacientoj kun T2DM, asocioj estis trovitaj inter la relativa longo de telomeroj kaj GPN, CRP, "malalta" telomerasa aktiveco, sed neniu korelacio estis trovita kun aĝo, sangopremo, IMC, HLA1c MDA, fibrinogeno, kaj IL-6 (Tabelo 6).
En la grupo CD2 +, pozitiva korelacio estis trovita nur inter telomerasa aktiveco kaj la tre longa telomera longo. En la kontrolgrupo, telomerasa aktiveco estis pozitive asociita kun SBP, DBP, CRP kaj fibrinogenaj niveloj (Tabelo 7).
Poste, multnombra linia regresiva analizo estis farita, kie la relativa longo de la telomeroj estis uzata kiel dependa variablo, kaj la aĝo, GPN, CRP, kaj "malalta" telomerasa aktiveco estis uzataj kiel sendependaj variabloj. Rezultis, ke nur GPN kaj CRP sendepende asocias kun la telomera longo (Tabelo 8).
Kiam uzante telomerasa agado kiel dependa variablo, kaj kiel sendependaj - aĝo, DBP, GPN, CRP, fibrinogeno, rezultis, ke en la grupo CD2, nur DBP (retrosciigo) kaj fibrinogeno (rekta rilato) estis sendepende asociitaj kun telomerasa aktiveco ( tabelo 9). En la grupo CD2 +, ne ekzistis sendependa rilato inter la studitaj parametroj kaj telomerasa aktiveco (Tabelo 10).
Ni trovis, ke en pacientoj kun tipo 2 diabeto, la longeco de la korpaj mezuroj estas averaĝe pli mallonga ol ĉe sanaj homoj. Ĝi estas
Tabelo 6. Rilato de la relativa telomera longo kun aliaj parametroj en la studitaj grupoj (Spearman-rango-korelacioj)
SD2 + (n = 50) SD2- (n = 139) telomere longo Telomere longo
Aĝo, jaroj -0,09, p = 0,52 -0,18, p = 0,035
ĜARDENO, mmHg -0.036, p = 0.81 -0.14 p = 0.09
DBP, mmHg 0,066, p = 0,65 -0,03 p = 0,75
IMC, kg / m2 -0,025, p = 0,87 -0,13 p = 0,13
GPN, mmol / L -0.42, p = 0.0027 -0.16 p = 0.05
HbA1c,% -0.23, p = 0.12 -0.03 p = 0.69
MDA, μmol / L -0,17, p = 0,24 0,07, p = 0,55
CRP, mg / L -0,40, p = 0,004 -0,05 p = 0,57
Fibrinogeno, g / l -0,18, p = 0,22 -0,04 p = 0,65
IL-6, pg / ml -0.034, p = 0,82 -0,04 p = 0,68
Telomerasa agado 0,15, p = 0,33 0,03, p = 0,78
Korpa aktiveco "Malalta"
merase -0.32, p = 0.035 -0.06, p = 0.61
Tabelo 7. Rilato de telomerasa agado kun aliaj parametroj en la studitaj grupoj (Spearman-rango-korelacioj)
Aktiveco de telomerasa SD2 + (n = 50) SD2- (n = 139)
Aĝo, jaroj de ĜARDENO, mm Hg DBP, mmHg IMC, kg / m2 GPN, mmol / L НАА1с,% MDA, μmol / L SRB, mg / L
Ĉeesto de pliigita CRP Fibrinogeno, g / l IL-6, PG / ml
La relativa longo de la korpo-mezuroj
Korpaj mezuroj tre longaj
5, p = 0,35 2, p = 0,44 4, p = 0,37 -0,07, p = 0,65 -014, p = 0,38 -0,08, p = 0,64 - 0,064, p = 0,69 0,056, p = 0,73 0,03, p = 0,89-0,086, p = 0,59-0,006, p = 0,59
0,07, p = 0,52 0,20, p = 0,08 0,33, p = 0,003
-0,04 -0,17 -0,08 -0,11
p = 0,72 p = 0,14 p = 0,47 p = 0,47
0,11, p = 0,35 0,35, p = 0,002 0,28, p = 0,01 -0,19, p = 0,12
0,15, p = 0,33 0,03, p = 0,78 0,40, p = 0,0095 0,14, p = 0,22
konformaj al la rezultoj de aliaj aŭtoroj. Tamen en studo de M. Sampson et al. neniu rilato estis trovita inter mallongigo de la longeco de limfocitaj telomeroj kaj indikiloj de karbonhidrata metabolo (eble pro la malgranda nombro de
Tabelo 5. Indikiloj de oksida streso, kronika inflamo kaj la relativa longo de telomeroj depende de la agado de telomerase (AT)
Parametro Malalta AT Alta AT
SD2 + SD2- r SD2 + SD2- r
MDA, μmol / L 3,23 + 1,01 1,34 + 0,72 0,68 2,93 + 0,90 3,06 + 0,93 0,68
IL-6, pg / ml 3,91 + 2,03 6,37 + 1,80 0,37 2,98 + 1,01 1,77 + 1,00 0,62
CRP, mg / L 7,12 + 1,76 2,55 + 0,26 0,016 5,34 + 1,40 4,14 + 0,78 0,44
Fibrinogeno, g / l 3,66 + 0,85 3,37 + 0,43 0,11 3,62 + 0,70 3,60 + 0,50 0,90
Ĉeesto de pliigita fibrinogeno 0,259 0,075 0,043 0,375 0,205 0,21
Relativa telomera longo 9,43 + 0,42 9,70 + 0,45 0,016 9,77 + 0,50 9,81 + 0,51 0,5
Tabelo 8. Dependeco de telomera longo en aĝo, GPN, CRP, malpliiĝis telomerasa aktiveco kiel sendependaj variabloj en pacientoj kun tipo 2 diabeto
Parametro B Norma eraro P
Aĝo, jaroj -0.0008 -0.008 0.92
GPN, mmol / L -0.076 0.036 0.004
CRP, mg / L -0.018 0,007 0,020
"Malalta" teloma agado
fojojn -0.201 0.125 0.116
Tabelo 9. Dependeco de telomerasa agado laŭ aĝo, DBP, GPN, CRP, fibrinogeno, GPN kiel sendependaj variabloj en la kontrolgrupo.
Parametro B Norma eraro P
Aĝo, jaroj -0,003 0,005 0,534
DBP, mmHg -0.010 0.004 0.012
GPN, mmol / L -0.105 0.081 0.20
CRP, mg / L 0.019 0.010 0.073
Fibrinogeno, g / l 0,205 0,080 0,013
Tabelo 10. Dependeco de telomerasa agado laŭ aĝo, DBP, GPN, CRP, fibrinogeno, GPN kiel sendependaj variabloj en la grupo de pacientoj kun tipo 2 diabeto.
Parametro B Norma eraro P
Aĝo, jaroj 0,002 0,008 0,74
DBP, mmHg -0.0001 0.006 0.98
GPN, mmol / L -0.006 0.039 0.15
CRP, mg / L 0,007 0,009 0,45
Fibrinogeno, g / l -0,009 0,089 0,91
STI-grupo). Nia studo malkaŝis signifajn diferencojn en HbA1c kaj GPN en pacientoj kun T2DM kun "longaj" kaj "mallongaj" telomeroj, kaj ankaŭ trovis negativan rilaton inter la longo de la telomero kaj GPN. Oni povas argumenti, ke en pacientoj kun tipo 2 diabeto, pli mallongaj telomeroj estas asociitaj kun malbona diabetokontrolo, kaj hiperglicemio, siavice, povas havi damaĝan efikon al replika maljuniĝo.
Ni trovis, ke telomerasa aktiveco en pacientoj kun diabeto tipo 2 estas pli malalta ol ĉe sanaj homoj, kio konformas al la malmultaj disponeblaj datumoj. La rolo de telomerazo en la procezo de normala maljuniĝo estas ambigua kaj nesufiĉe studita. Ni ne malkaŝis rilaton inter telomerasa agado kaj telomera longo, kio konformas al la opinio, ke la rolo de telomeraso estas sensignifa por konservi homeostazon de telomera longo en maljuneco.
La damaĝa efiko de hiperglicemio sur la biologio de telomeroj, inkluzive en endoteliaj ĉeloj, realiĝas per la mekanismo de oksida streso kaj kronika inflamo. Tamen signifa
Ne estis diferencoj en la nivelo de MDA inter la grupoj de T2DM + kaj T2DM (probable pro la mallonga daŭro de diabeto kaj foresto de severa kronika hiperglicemio, ĉar longtempa hiperglicemio asocias kun la disvolviĝo de severa kaj persista oksida streso). Eble necesas uzi pli precizajn indikilojn de oksida streso, kiel ekzemple urina ekskrecio de 8-iso-prostaglandina F2a. Ni trovis pli altajn nivelojn de inflamaj markiloj en pacientoj kun tipo diabeto ol en individuoj en la grupo de kontrolo. Alia inflama markilo, IL-6, kiel ĝi estis malkaŝita lastatempe, havas multoblajn efikojn, estante ne nur citokino, sed ankaŭ miokino, stimulanta miogenezon kaj profitigas energian metabolon. Eble tial la nivelo de IL-6 en la kontrolo rezultis iom pli alta, kio tamen bezonas plian studadon.
Kronika inflamo kondukas al antaŭtempa ĉela maljuniĝo, mallongigo de telomeroj per aktivado de la proliferado de limfocitaj ĉeloj kaj aktivigado de la liberigo de ROS, kaŭzante oksidan damaĝon al la fina parto de la DNA. En 2012, oni montris, ke la progresiva mallongigo de telomeroj kun pliigo de la daŭro de T2DM eble estas asociita kun paralela kresko de oksida streso kaj kronika inflamo. Niaj rezultoj konformas al datumoj de antaŭaj studoj. Ni trovis pli altajn nivelojn de CRP kaj iomete pli altajn nivelojn de MDA en pacientoj kun tipo 2 diabeto kaj mallongaj telomeroj ol en pacientoj kun longaj telomeroj. Estis negativa rilato inter la longeco de la limfocita telomero kaj la klasika markilo de kronika inflamo - CRP, kiu indikas la implikiĝon de kronika inflamo en mallongigo de telomeroj en pacientoj kun tipo 2 diabeto. En la grupo de kontrolo, ne estis rilato inter CRP kaj telomera longo, kio kongruas kun la rezultoj de aliaj studoj. La manko de komunikado inter IL-6, fibrinogeno, kaj telomera longo en ambaŭ grupoj povas esti klarigita per la malalta variableco de ĉi tiuj indikiloj. Plie, fidante nur al la nivelo de cirkulantaj citokinoj, oni povas subtaksi la gradon de loka inflamo en la histoj.
La literaturaj datumoj pri la rilato de kronika inflamo kun telomerasa agado estas kontraŭdiraj. Longdaŭra kronika inflamo kondukas al elĉerpiĝo de telomerase, kiun ni observis en pacientoj kun tipo 2 diabeto. Kun malpli prononcita kaj malpli longedaŭra kronika inflamo, kiel okazas kun metabola sindromo aŭ modera aterosklerozo, kontraŭe estas pliigo de telomerasa agado, kiu probable kompensas naturon, malrapidigante la malpliiĝon de telomere-longo en aktive dividantaj ĉeloj.
sub la influo de inflamaj citokinoj. Efektive, en la grupo de kontrolo, ni trovis pozitivan rilaton inter telomerasa aktiveco kaj markiloj de kronika inflamo.
Estas grave substreki, ke laŭ niaj datumoj, la nivelo de oksida streso, kronika inflamo kaj telomerasa aktiveco en pacientoj kun T2DM kaj "longaj" telomeroj ne diferencis signife de la respondaj indicoj en sanaj individuoj. Oni povas supozi, ke kun mallonga daŭro de T2DM, genetike determinita longa telomera longo protektas pacientojn kontraŭ damaĝaj efikoj de oksida streso kaj kronika inflamo, havigante pli bonan kaj pli rapidan restarigon de damaĝitaj histoj, inkluzive de sangaj glasoj. Kontraŭe, en pacientoj kun T2DM kaj "mallongaj" telomeroj, eĉ kun mallonga daŭro de la malsano, la severeco de kronika inflamo kaj la grado de malpliiĝo de telomerasa aktiveco estis pli signifaj. Oni devas memori, ke pacientoj de tipo 2-diabeto kaj kontrolo estis kompareblaj en aĝo.
Estas kreskantaj evidentoj, ke mallongigo de telomeroj estas ŝlosila ero en reduktado de rezervaj ĉelaj rezervejoj kaj degenerado de histoj asociitaj kun aĝo. La asocio de T2DM kun la procezoj de ĉela maljuniĝo kaj la severeco de kronika inflamo kaj oksida streso povas klarigi la pli altan efikon de CVD en ĉi tiu malsano. Pluaj studoj permesos konsideri la telomere longon inter pacientoj kun tipo 2 diabeto, grupo de homoj, kiuj bezonas pli agreseman kontrolon de karbonhidrata metabolo, kio donos pli personecan aliron al kuracado de la malsano.
1. En pacientoj kun tipo 2 diabeto, longoj de telomeroj estas averaĝe pli mallongaj, kaj telomerasa agado malpli ol ĉe sanaj homoj. La valoroj de la agado de la korpo-meraseco dum ŝanĝo de la longeco de la telomeroj ne estis rivelitaj.
2. La nivelo de MDA en pacientoj kun tipo 2 diabeto kaj sanaj individuoj estas preskaŭ la sama. Kronika inflamo estas pli prononcita en pacientoj kun tipo 2 diabeto ol ĉe sanaj individuoj de simila aĝo. Kronika inflamo ludas ĉefan rolon por mallongigi telomerojn kaj pliigi telomeragan agadon.
3. En pacientoj kun T2DM kaj "longaj" telomeroj, la severeco de oxidativa streso kaj kronika inflamo ne diferencas de la respondaj parametroj en sanaj individuoj.
4. En pacientoj kun T2DM, "mallongaj" telomeroj asocias kun malbona kontrolo de diabeto kaj pli severa kronika inflamo.
5. “Longaj” telomeroj protektas pacientojn kun diabeto kontraŭ la damaĝaj efikoj de oxidativa streso kaj kronika inflamo.
Ne ekzistas konflikto de intereso.
La studo estis farita kiel parto de la ŝtata tasko "La studo de la molekulaj mekanismoj de aterogenezo por disvolvi metodojn por la frua diagnozo de preklinika aterosklerozo kiel ĉefa fiziopatologia mekanismo por disvolviĝo de kardiovaskulaj malsanoj kaj iliaj komplikaĵoj."
Esplora koncepto kaj desegno - E.N. Dudinskaya, O.N. Tkacheva, I.D. Strazhesko, E.V. Akasheva.
Kolekto kaj prilaborado de materialo - N.V. Brailova, E.V. Plohova, V.S. Pihtina.
Statistika prilaborado de datumoj - V.A. Bonfarta.
Skribi tekston - N.V. Brailova.
Redaktado - E.N. Dudinskaya, O.N. Tkacheva, M.V. Ŝstakova, S.A. Batalantoj.
La teamo de aŭtoroj dankas A.S. Kruglikov, I.N. Ozerov, N.V. Gomyranova (Federacia Ŝtata Buĝeta Institucio "Ŝtata Esplorcentro por Antaŭzorga Medicino" de la Sanministerio de la Rusa Federacio) kaj D.A. Skvortsov (Instituto pri Fizika kaj Kemia Biologio nomita laŭ AN Belozersky GBOU VPO MSU nomita laŭ MV Lomonosov) por helpo en la realigo de la studo.
1. Rajendran P, Rengarajan T, Thangavel J, et al. La vaskula 4 endotelio kaj homaj malsanoj. Int J BiolSci. 2013.9 (10): 1057-1069. doi: 10.7150 / ijbs.7502.
2. Rodier F, Campisi J. Kvar vizaĝoj de ĉela senescenceco. J Cell Biol. 2011,192 (4): 547-556. doi: 10.1083 / jcb.201009094.
3. Inoguchi T, Li P, Umeda F, et al. Alta glukoza nivelo kaj senpaga grasa acido stimulas reaktivan oksigenan produktadon per proteino 6-kinasa C-dependa aktivado de NAD (P) H-oksasezo en kulturitaj vaskulaj ĉeloj. Diabeto. 2000.49 (11): 1939-1945.
Benetos A, Gardner JP, Zureik M, et al. Mallongaj telomeroj estas asociitaj kun pliigita karotida aterosklerozo en hipertensaj aferoj. Hipertensio 2004.43 (2): 182-185. doi: 10.1161 / 01.HYP.0000113081.42868.f4.
Shah AS, Dolan LM, Kimball TR, et al. Influo de Daŭro de Diabeto, Glicemia Kontrolo kaj Tradiciaj Kardiovaskulaj Riskaj Faktoroj sur Fruaj Atherosclerotaj Vaskulaj Ŝanĝoj en Adoleskantoj
kaj Junaj Plenkreskuloj kun Tipo 2 Diabetes Mellitus. J Clin Endocr Metab. 2009.94 (10): 3740-3745. doi: 10.1210 / jc.2008-2039.
7. Zvereva M.E., Scherbakova D.M., Dontsova O.A. Telomerazo: strukturo, funkcioj kaj manieroj reguligi agadon. // Sukcesoj en biologia kemio. - 2010 .-- T. 50 .-- S. 155-202. Zvereva ME, Ŝcherbakova DM, Dontsova OA. Telomeraza: struktura, funktsii i puti regulyatsii aktivnosti. Uspekhi biologicheskoi khimii. 2010.50: 155-202. (En Russ.)
8. Morgan G. Telomerase-regulado kaj la intima rilato kun maljuniĝo. Esplorado kaj Raportoj pri Biokemio. 2013.3: 71-78.
9. Effros RB. Telomero / telomerasa dinamiko ene de la homa imunsistemo: Efiko de kronika infekto kaj streso. Exp Gerontol. 2011.46 (2-3): 135-140.
10. Ludlow AT, Ludlow LW, Roth SM. Ĉu Telomeres Adaptiĝas al Fiziologia Streso? Esplorante la Efikon de Ekzerco sur Telomere-Longeco kaj Telomere-rilataj Proteinoj. Internacia Esploro BioMed. 2013,2013: 1-15.
11. Ghosh A, Saginc G, Leow SC, et al. Telomerase rekte reguligas transskribaĵon de NF-xB. Nat Cell Biol. 2012.14 (12): 1270-1281.
12. Qi Nan W, Ling Z, Bing C. La influo de la telomere-telomerasa sistemo sur diabeto mellitus kaj ĝiaj vaskulaj komplikaĵoj. Spertaj Opiniaj Temoj. 2015.19 (6): 849-864. doi: 10.1517 / 14728222.2015.1016500.
13. Cawthon RM. Mezuro de telomeroj per kvanta PCR. Nukleaj Acidoj Res. 2002.30 (10): 47e-47.
14. Kim N, Piatyszek M, Prowse K, et al. Specifa asocio de homa telomerasa agado kun senmortaj ĉeloj kaj kancero. Scienco. 1994.266 (5193): 2011-2015.
15. Huang Q, Zhao J, Miao K, et al. Asocio inter Telomere-Longeco kaj Tipo 2 Diabetes Mellitus: Meta-Analizo. Plos unu. 2013.8 (11): e79993.
16. Sampson MJ, Winterbone MS, Hughes JC, et al. Mallongigo de telomeraj monokitoj kaj damaĝo de oksidativa DNA en diabeto de tipo 2. Diabeta Prizorgo. 2006.29 (2): 283-289.
17. Kuhlow D, Florian S, von Figura G, et al. La manko de telomerase difektas glukozan metabolon kaj sekrecion de insulino. Maljuniĝo (Albany NY). 2010.2 (10): 650-658.
18. Pal M, Febbraio MA, Whitham M. De citokino ĝis miokino: la emerĝa rolo de interleukino-6 en metabola regulado. Ĉela Biol Immunol. 2014.92 (4): 331-339.
19. Lichterfeld M, O'Donovan A, Pantell MS, et al. Akumula Inflacia Ŝarĝo Estas Asociita Kun Mallongaj Leŭkocitaj Telomeraj Longoj en la Studo pri Sano, Maljuniĝo kaj Korpa Komponado. Plos unu. 2011.6 (5): e19687.
20. Federici M, Rentoukas E, Tsarouhas K, et al. Ligo inter Telomerasa Aktiveco en PBMC kaj Markiloj de Inflamado kaj Endotelia Disfunkcio en Pacientoj kun Metabola Sindromo. Plos unu. 2012.7 (4): e35739.